
让循环肿瘤细胞无处藏身
二十世纪以来人类的生活环境污染日趋加剧,生活环境不断恶化,人们与致癌因素的接触越来越紧密,恶性肿瘤的发病率也逐年递增,恶性肿瘤已超过心脑血管成为人类健康的最大敌人【1】。人们普遍认为原发肿瘤向远端扩散是癌症死亡的主要原因,90%的癌症相关死亡是由转移引起的【2】。而循环肿瘤细胞(CTC)的存在正是实体恶性肿瘤远处转移的根源,被认为是转移的"种子"。
种子从哪里来
1869年澳大利亚籍医生Ashworth首次在癌症死亡患者血液中发现并提出CTC的概念,CTC是来源于原发肿瘤或转移肿瘤,获得脱离基底膜的能力并通过组织基质进入血管的肿瘤细胞【3】。而肿瘤发生远处转移的最经典依据是1889年StephenPaget通过分析乳腺癌患者的尸解数据后提出种子与土壤学说,该学说认为肿瘤转移的发生和发展是特定的肿瘤细胞作为种子,当遇到适合的器官、组织的基质环境,也就是土壤时,就会在此定居、生长即发生肿瘤的转移。但原发部位的"种子"是如何到达远处"土壤"的这一问题一直困扰着人们。

"种子"是如何离开土壤的呢?上皮间质转化过程(EMT)被认为是解释"种子-土壤"假说的关键过程。上皮细胞排列紧密,间质细胞排列较为疏松,而EMT过程是指上皮细胞在形态学上发生向间充质细胞表型转变的过程,它可以赋予细胞转移和入侵的能力,肿瘤细胞在一定条件下发生EMT过程就会有更强地侵袭和转移能力,当找到合适的"土壤"环境时就会在此生长【4】。
检测"种子"的利器
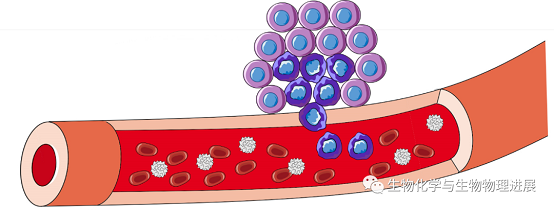
CTC在血液中含量及其稀少,血液中109个血细胞中混杂着极少数量的CTC,很多研究表明平均每毫升血液中只有1~10个CTC,并且其以不同的形态进入外周血中【5】,所以CTC的富集检测工作成为一大难题。
纳米材料具有体积小、易修饰、比表面积大等优点,近些年又以其突出的磁性、光学和电学性质被广泛用于细胞生物学领域【6-8】。因此,在纳米材料的帮助下我们可以将CTC从血细胞中区分开。
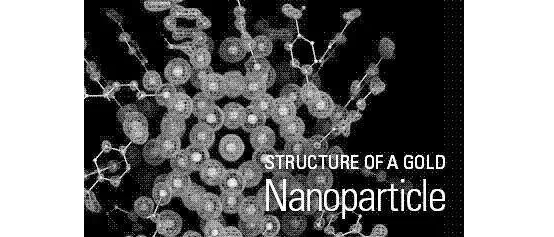
纳米材料是指结构尺寸在1~100 nm的材料,当材料具有纳米尺寸时,其物理化学性能就会发生与尺寸密切相关的变化。近些年来各种各样的新型纳米材料被用来对CTC进行捕获,例如纳米颗粒、纳米柱和纳米纤维等。这些纳米材料通过连接抗体等生物识别原件对CTC进行识别捕获,再利用自身的优势,例如优良的光学性能、磁学性能、电学性能等对其进行检测,这样就可以将捕获检测一体化【9】。以金纳米颗粒为例,纳米颗粒表面具有较大的比表面积,可以附着更多的抗体,这种抗体是CTC独有而血细胞没有的,抗原与抗体结合,CTC便被金纳米颗粒从血细胞中挑选出来,接下来,金纳米颗粒发挥它良好的荧光特性,通过将CTC"点亮"使得它又与其他血细胞不同,从而对其进行检测【10】。
除了纳米材料外,微流控芯片也被开发用于体外CTC检测,利用CTC和血细胞之间的生物学差异,微流控平台可以从数百万个血细胞中精确分离到CTC【11】。什么是微流控芯片呢?顾名思义,微流控芯片是一种微米尺度的芯片,它就像是一个迷你的加工厂,样品的制备、反应、分离等操作单元都在这里进行。微流控芯片中有能够容纳流体的微米级通道,可对液体的流动进行精准地控制,由于尺度是微米级的,也减少了溶剂的消耗,分析速度极大提高。当血液进入微流控通道后,芯片会根据血细胞和CTC的物理性质不同使其通过不同的通道输出,这样血细胞和CTC得以分离。随着纳米技术的发展,一些新型纳米材料也可以集成到芯片中,使细胞的分离和处理更加便捷高效。纳米材料修饰的微流控芯片是通过改变基底的结构和功能来提高其与细胞的接触频率从而提高捕获效率。除此之外,为了确保捕获准确性,还可以进行"双保险"捕获,这种方法是先通过功能化纳米材料进行初富集,再进入到微流控芯片进行再富集,充分发挥两者各自的优势,确保捕获CTC的准确性【12】。

除了有效的富集外,CTC的检测也同样重要。人全血是一种由红细胞、白细胞、血小板等成分组成的复杂液体。其中红细胞容易干扰CTC的识别,同时大量白细胞也很大程度增加了捕获难度,因此有必要进一步对捕获的癌细胞进行检测和分析。新材料的研发成为CTC 检测的重中之重,纳米材料优良的电学、光学等特性成为CTC检测的首选材料。电化学免疫传感器以其简单、低成本的特点广泛应用于实验室和临床分析领域。金属团簇、量子点、石墨烯、金属氧化物等用作信号载体、催化剂或发光体在电化学免疫传感中可起放大信号的作用【13】。光学分析作为一种灵敏度高、重复性好、快速高效的分析方法,在生物分析技术中得到广泛的应用,光学生物传感器是目前研究较为广泛、发展较快的传感器之一。纳米颗粒、金属团簇、量子点、上转换发光纳米粒子等都具有较强的光学特性,对CTC捕获的同时也可进行光学检测分析【14】。
CTC的精准捕获与检测可为肿瘤患者的早期诊断、预后和有效治疗提供重要依据。而纳米材料和纳米技术将是研究CTC最关键的法宝,未来有望从血液检测到单细胞分析,纳米材料可做到一站式解决,为CTC检测技术的临床应用奠定良好的基础。(详情请点击阅读原文

参考文献:
【1】Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA, 2018, 68(6): 394-424
【2】Lambert A W, Pattabiraman D R, Weinberg R A. Emerging biological principles of metastasis. Cell, 2017,168(4):670-691
【3】Ashworth T R. Acase of cancer in which cells similar to those in the tumours were seen in the blood after death. Aust Med J, 1869,14: 146-149
【4】Nieto M A, Huang R Y J, Jackson R A, et al. EMT: 2016. Cell, 2016, 166(1): 21-45
【5】Abouleila Y, Onidani K, Ali A, et al. Live single cell mass spectrometry reveals cancer‐specific metabolic profiles of circulating tumor cells. Cancer Science, 2019, 110(2): 697-706
【6】Po J W, Roohullah A, Lynch D, et al. Improved ovarian cancer EMT-CTC isolation by immunomagnetic targeting of epithelial EpCAM and mesenchymal N-cadherin. J Circ Biomark, 2018, 7:1849454418782617
【7】Marks H L, Pishko M V, Jackson G W, et al. Rational design of a bisphenol a aptamer selective surface-enhanced raman scattering nanoprobe. Analytical Chemistry, 2014, 86(23): 11614-11619
【8】Wu S, Gu L, Qin J, et al. Rapid label-free isolation of circulating tumor cells from patients' peripheral blood using electrically charged Fe3O4 nanoparticles. ACS Appl Mater Interfaces, 2020,12(4): 4193-4203
【9】Poudineh M, Aldridge PM, Ahmed S, et al. Tracking the dynamics of circulating tumour cell phenotypes using nanoparticle mediated magnetic ranking. Nat Nanotechnol, 2017, 12(3): 274-281
【10】Wang Z, Sun N, Liu H, et al. High-efficiency isolation and rapid identification of heterogeneous circulating tumor cells (CTCs) using dual-antibody-modified fluorescent-magnetic nanoparticles. ACS Appl Mater Interfaces, 2019, 11(43): 39586-39593
【11】Stott S L, Hsu C H, Tsukrov D I, et al. Isolation of circulating tumor cells using a microvortex-generating herringbone-chip. Proc Natl Acad Sci USA, 2010, 107(43): 18392-18397
【12】Wu L L, Tang M, Zhang Z L, et al. Chip-assisted single-cell biomarker profiling of heterogeneous circulating tumor cells using multifunctional nanospheres. Anal Chem, 2018, 90(17): 10518-10526
【13】Liu P, Wang L, Zhao K, et al. High luminous efficiency Au@CDs for sensitive and label-free electrochemiluminescent detection of circulating tumor cells in serum. Sensors and Actuators B: Chemical, 2020, 316: 128131
【14】Yu Y, Yang Y, Ding J, et al. Design of a biocompatible and ratiometric fluorescent probe for the capture, detection, release, and reculture of rare number CTCs. Anal Chem, 2018, 90(22): 13290-13298
作者简介:
陈璐,北京工业大学硕士研究生。本科专业为材料化学,研究生专业为物理化学。现阶段主要从事基于纳米材料的循环肿瘤细胞捕获与检测的研究。
(作者:陈璐)
(本文来源于公众号: 生物化学与生物物理进展)
附件下载: