2015年7月23日,中国科学院生物物理所高光侠研究组在Cell Host & Microbe发表了题为“HIV-1 Exploits the Host Factor RuvB-like 2 to Balance Viral Protein Expression”的研究成果。该研究发现宿主细胞编码的蛋白RuvB-like 2(RVB2)抑制病毒结构蛋白(Gag)的表达,而HIV-1编码的囊膜蛋白(Env)拮抗了RVB2的功能。HIV-1利用上述作用机制,有效控制了不具有感染性病毒颗粒的产生。
HIV-1的病毒颗粒由结构蛋白(Gag)、囊膜蛋白(Env)和病毒基因组RNA组成,里面还有少量的酶和其他附属蛋白。基质蛋白(MA)位于Gag蛋白的N端,在病毒颗粒成熟的过程中,由病毒编码的蛋白酶剪切Gag而成。结构蛋白和膜蛋白的分子数量决定了病毒颗粒的组装和感染的有效性,而病毒如何调控各自蛋白的相对比例,目前没有明确的定论。病毒的复制依赖于宿主细胞,为了对抗病毒的感染,宿主细胞进化出了多种抗病毒蛋白,在病毒复制的不同阶段发挥抑制的功能。而在长期的共同进化中,病毒也发展出了拮抗或逃逸宿主抗病毒因子的机制。RVB2是一种非常重要的宿主蛋白,参与了基因转录调控、端粒酶复合物组装、无义mRNA稳定性调控等生物学活动。此外,RVB2通过抑制流感NP蛋白的寡聚化减少病毒颗粒的产生。对于RVB2是否具有其他的抗病毒活性,之前并没有报道。
本文作者通过串联亲和纯化(TAP)的方法,发现RVB2与MA相互作用。进一步的分析发现,RVB2通过结合病毒mRNA的5’UTR和翻译中的MA蛋白,抑制Gag的翻译;HIV-1通过自身编码的囊膜蛋白的C末端竞争性结合MA,阻止了RVB2同MA的结合,从而拮抗了RVB2的功能。在病毒产生早期,囊膜蛋白的表达量很低,内源的RVB2有效控制了病毒Gag的表达,从而降低了病毒颗粒的产生。通过这一机制,HIV-1有效避免了产生因缺少囊膜蛋白而不具感染性的病毒颗粒。随着HIV-1囊膜蛋白表达的积累,产生了有效拮抗RVB2的条件,Gag的表达不再被抑制,从而保证了可感染性病毒颗粒的产生。HIV-1利用这种抑制与拮抗的机制,减少了不含有囊膜蛋白的病毒颗粒的产生,从而降低了由此带来的机体免疫系统的识别。临床数据分析发现,RVB2与HIV-1病人的疾病进程也呈正相关性,从而支持了HIV-1利用RVB2完成自身有效复制的观点。
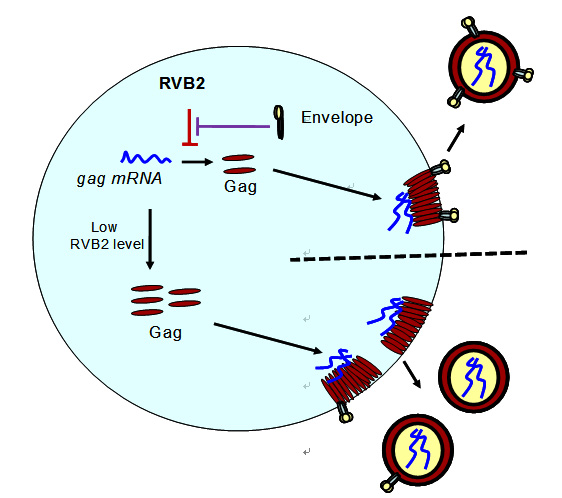
图:RVB2与HIV-1相互作用的模式图
本文通讯作者单位为生物物理研究所。感谢参与部分研究的中国医科大学附属第一医院尚红教授,美国哥伦比亚大学Stephen P. Goff教授,该研究得到科技部国家重点基础研究发展计划、科技部国家科技重大专项、国家自然科学基金、中国科学院和NIH的资助。
(供稿:高光侠课题组)
