2014年7月1日,《Cell Research》杂志在线发表了中科院生物物理研究所范祖森研究组名为“RNF2 is recruited by WASH to ubiquitinate AMBRA1 leading to downregulation of autophagy”的论文,报道了WASH蛋白通过招募RNF2蛋白调控自噬的新机制。
自噬(autophagy)是细胞内存在的一种基本生物学现象。在细胞受到外界刺激的情况下,细胞内会形成双层膜包裹的膜状结构,将错误折叠的蛋白或发生异常的细胞组分运输到溶酶体中进行降解,从而为细胞提供新的营养成分,维持着细胞的自我更新。该研究组在前期发现,Beclin 1蛋白在自噬过程中会发生非降解型的泛素化修饰,泛素化修饰后的Beclin 1与Vps34的结合能力更强,促进了Vps34磷酯酰激酶活性(Xia P, et al. EMBO J, 2013)。WASH蛋白能够抑制Beclin 1的泛素化修饰,抑制了Vps34磷酯酰激酶活性,从而抑制自噬的发生。
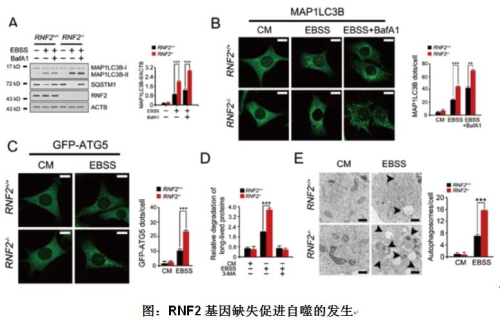
该研究组进一步研究发现,在自噬发生的过程中,WASH蛋白除了能够通过抑制Beclin 1蛋白的泛素化来抑制自噬的发生,还能招募RNF2蛋白对自噬的核心复合物进行蛋白水平的调节。在自噬发生的早期,Ambra1-Beclin 1-Vps34复合物对自噬小体的形成以及延伸起到了非常重要的作用,其复合物的稳定性与自噬的活性高低有着直接的关系。研究者发现,在自噬发生时,Ambra1蛋白会发生非常显著的蛋白水平下降过程。这一过程是通过蛋白酶体介导的泛素化降解途径实现的。通过酵母双杂交及免疫共沉淀等技术,研究者发现泛素连接酶RNF2能够和Ambra1结合。RNF2能够结合Ambra1介导了Ambra1的多泛素化修饰,WASH蛋白加速了这一进程。利用RNF2基因缺失小鼠,体内验证了RNF2对自噬的调节作用。综上所述,WASH蛋白通过招募RNF2降解 Ambra1蛋白,从而抑制了Beclin 1蛋白的泛素化修饰,进而抑制自噬的发生。
范祖森研究组的博士研究生夏朋延和副研究员王硕为本文的共同第一作者。此外,该研究组的黄贯岭、杜颖、朱平平、李曼也对本研究做出重要贡献。该工作得到科技部、国家自然基金委、中科院先导项目的资金资助。
文章链接:
http://www.nature.com/cr/journal/vaop/ncurrent/full/cr201485a.html
(供稿:范祖森课题组)
