抗菌肽(Antimicrobial peptides,AMPs)和抗菌酶(Antimicrobial enzymes,AMEs)作为非常有前景的非抗生素类抗菌药物,具有特异杀菌、生物相容性高、绿色安全等优势,有望为解决微生物耐药难题提供新策略。然而,大多数抗菌肽杀菌效率不高,且稳定性较差,尤其是较长序列的抗菌肽不仅成本高,还容易引发免疫原性;类似的,抗菌酶通过催化破坏菌壁而杀菌,但是需要较长作用时间,而且作为天然蛋白酶容易失活,稳定性低,成本较高,且具有免疫原性。这些不足限制了抗菌肽和抗菌酶的实际应用。为了克服这些问题,中国科学院生物物理研究所高利增研究组根据仿生原理,提出基于纳米酶模拟抗菌肽和抗菌酶的杀菌机制,设计开发双功能高效抗菌纳米酶。纳米酶是具有类酶催化活性的纳米材料,具有高稳定性、高活性、多功能、低成本等优势,是新一代人工模拟酶,有望在生物医学、农业等诸多领域的应用。高利增研究组前期发现多种具有氧化还原酶类活性的纳米酶能够模拟溶酶体杀菌原理,高效杀死多种耐药菌,其以细菌铁死亡为主的杀菌机制,显著区别于现有抗生素和其他抗菌材料,据此提出纳米酶抗生素(Nanozybiotics)新概念,有望为克服细菌耐药提供新策略(Advanced Materials 2024,2403362)。该研究从多肽纳米酶理性设计出发,基于抗菌肽和抗菌酶中活性部位的关键氨基酸包括组氨酸、半胱氨酸,结合多肽自组装和金属配位规律,利用Alphafold2、分子动力学模拟及密度泛函理论等多种计算机手段,优化筛选得到了一组IHIHICI的7肽序列,通过自组装形成纳米酶兼具AMPs和AMEs功能(AMPANs),展现出对真菌的特异高效杀菌作用。
研究人员发现,醋酸根能有效调节无规则卷曲的游离7肽向β-sheet纳米管的转变。乙酸盐中的吸电子基团会抑制纳米管形态的形成,而供电子碳链则会促进纳米管的形成。此外金属离子如Cu2+和Fe2+同样能够调节纳米管的形态,而Ni2+不影响纳米管的形成,因此选择了Ni(Ac)2组装的多肽纳米管(Ni-IH-7)作为后续研究对象。酶学研究表明Ni-IH-7具有磷脂酶c样活性和过氧化物酶样活性,其催化活性中心主要是Ni2+和His形成的配位结构。理论计算表明,Ni-IH-7多肽水解纳米酶在催化水解底物时,主要由Ni2+作为辅因子介导磷脂分子中P-O键的断裂,同时在有Ni2+时水解反应的吉布斯自由能变化比没有Ni2+情况下的反应低0.51eV。而且,Ni-IH-7多肽纳米酶由于形成了稳定的二级结构纳米管,对多种水解酶均表现出良好的耐受能力。
研究人员进一步发现Ni-IH-7多肽纳米酶能够靶向结合白色念珠菌表面的甘露聚糖,诱发脂质过氧化造成铁死亡以及甘油磷脂的水解,从而快速杀死真菌,针对不同耐药真菌菌株效果均优于抗真菌药物5-氟胞嘧啶、氟康唑、两性霉素B及伊曲康唑 。根据这些实验结果,研究人员认为Ni-IH-7多肽纳米酶具有特异性杀真菌的功能。为了验证Ni-IH-7多肽纳米酶的实际应用潜力,研究人员将其固定在医用垫单上,发现垫单在10分钟内即可杀死> 90%的白色念珠菌。针对阴道炎患者分泌物,体外菌落涂板实验证明,Ni-IH-7多肽纳米酶具有较好的杀真菌效果且杀菌性能不被分泌物中其它物质干扰。
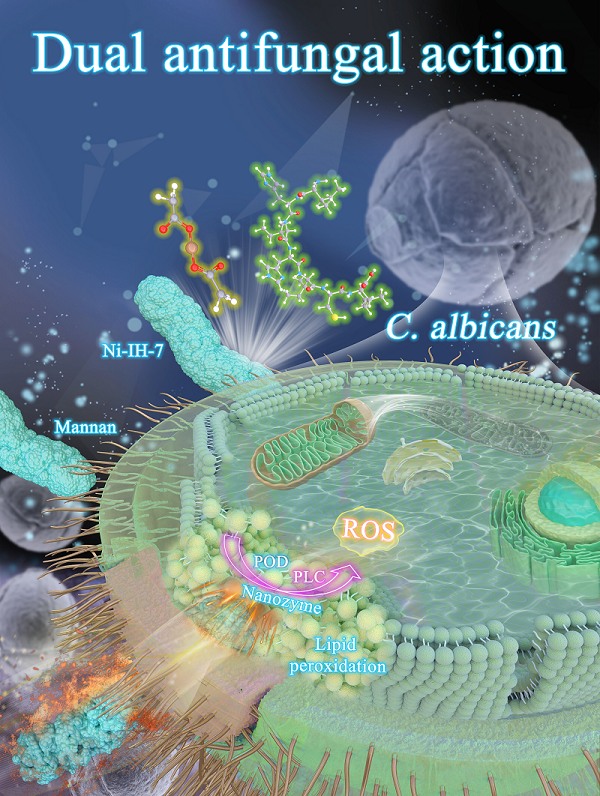
图:Ni-IH-7多肽纳米酶抗菌作用机制
该研究首次提出将抗菌肽和纳米酶结合的策略,通过计算机模拟从头设计合成了多肽纳米酶,并系统地研究了其特异性杀伤真菌的机制,为新型抗菌药物的研发提供了思路。这项研究成果于2024年7月5日在线发表在《Nature Communications》期刊上,题为"Stable peptide-assembled nanozyme mimicking dual antifungal actions"。中国科学院生物物理研究所的高利增研究员为通讯作者,郑州大学青年教师袁野为第一作者。中国科学院生物物理研究所的陈雷副研究员协助完成相关理论计算分析工作,章新政研究组的孔令斐博士协助完成了冷冻电镜成像与分析工作。该研究得到了国家重点研发计划、国家自然科学基金创新群体和重点等项目的资助。
文章链接:https://www.nature.com/articles/s41467-024-50094-6
(供稿:高利增研究组)
 附件下载:
附件下载: