纳米酶是一类新型催化剂,能够在生理或低温/高温条件下催化酶的底物,作为天然酶的替代品服务于人类健康。鉴于纳米酶的独特性,及其比天然酶稳定、可控、多功能且更容易大规模生产的特点,如今纳米酶已发展成为新兴交叉学科,其应用研究也从体外诊断发展到体内催化治疗。
在肿瘤治疗方面,纳米酶催化过氧化氢(H2O2)产生活性氧自由基杀伤肿瘤细胞的策略具有很大应用潜力。然而,肿瘤微环境中低浓度的H2O2 (低于0.1 mM)却限制了其治疗效果。中性粒细胞多酶级联的杀伤机制为该问题的突破提供了新思路。中性粒细胞吞噬病原体后形成吞噬体,吞噬体主要通过氧化还原酶的多酶级联反应进行氧化杀伤并利用多种水解酶进行消化作用。超氧化物歧化酶(SOD)和髓过氧化物酶(MPO)是氧化杀伤的主要参与酶。SOD将超氧离子(O2·-)歧化为H2O2和氧气,产生的H2O2与氯离子共同作为MPO的底物,生成强氧化剂次氯酸(HClO)和单线态氧(1O2),从而进行肿瘤细胞或微生物的高效杀伤。然而目前报道具有类MPO活性的纳米酶很少,而且即便具有类MPO活性,由于没有SOD活性生成H2O2作为MPO活性的底物,治疗过程通常需要额外添加H2O2,这不仅增加了治疗的复杂性,也提高了随后临床转化的难度。
2024年2月22日,《Nature Communications》杂志在线发表了中国科学院生物物理研究所阎锡蕴院士/范克龙研究员团队的最新研究进展(示意图)。研究人员模拟中性粒细胞酶促级联杀伤肿瘤的原理,发展了一种同时具有类SOD和类MPO活性的纳米酶。研究人员通过调整合金比例研发了一系列超小金属纳米酶:Au,Au3Pd1,Au2Pd2,Au1Pd3,Pd,并发现这些纳米酶具有合金比例依赖的类SOD和类MPO活性,其中Au1Pd3合金纳米酶呈现出最高的级联活性。DFT计算结果表明Au1Pd3合金纳米酶的高级联活性得益于其高d带中心和对O2·-的强相互作用。因此,Au1Pd3合金纳米酶能够模拟中性粒细胞的SOD-MPO级联杀伤作用,通过产生HClO和1O2引起DNA损伤和细胞凋亡,在小鼠结肠癌CT26和乳腺癌4T1两种移植瘤模型中显著抑制肿瘤的生长,明显延长荷瘤小鼠的生存期。此外,Au1Pd3合金纳米酶还具有良好的体内安全性,这主要是由于其催化底物O2·-在肿瘤细胞的浓度高于正常细胞,使其细胞毒性具有肿瘤特异性;而且该纳米酶的超小尺寸(小于6纳米)使其具备肾清除功能,避免了纳米酶在体内的长期积累。
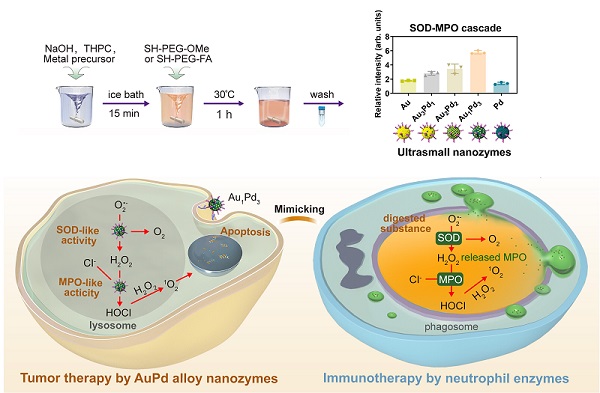
示意图:中性粒细胞酶促杀伤启发的纳米酶研发及其肿瘤催化治疗应用
该研究模拟中性粒细胞多酶级联反应进行肿瘤治疗的仿生策略,将推动更多仿生治疗方法的开发,以用于抗菌、肿瘤或其他疾病的治疗。而利用多酶活性纳米酶模拟含多种天然酶吞噬体的思路,也将促进纳米酶模拟细胞器(如溶酶体、过氧化物酶体等)方面的研究,未来有可能打造出纳米酶人造细胞器,乃至纳米酶人造细胞。此外,该研究中纳米酶具有的类MPO活性是一种新型的纳米酶催化类型,目前研究仍然较少,鉴于其在肿瘤治疗、抗菌等方面的应用潜力以及该研究对其催化机制的阐明,将促进更多类MPO活性纳米酶的发现和设计。
中国科学院生物物理研究所阎锡蕴院士和范克龙研究员为本论文通讯作者,中国科学院生物物理研究所博士后孟祥芹、樊慧真,助理研究员陈雷和北京理工大学材料学院副研究员贺久洋为论文共同第一作者。国家纳米中心高兴发研究员为理论计算分析提供了支持和帮助。中国科学院生物物理研究所高利增研究员对本工作提供了重要支持和帮助。该研究得到国家自然科学基金、国家重点研发计划、中国科学院青年创新促进会、生物大分子国家重点实验室等项目的资助。
文章链接:https://www.nature.com/articles/s41467-024-45668-3
 附件下载:
附件下载: