铁蛋白载硒降解融合蛋白AML1-ETO诱导分化治疗急性髓系白血病新机制
白血病是一类严重危害人类健康的恶性血液肿瘤,位居儿童恶性疾病死亡率第一位。其中,急性髓系白血病(AML)是白血病中发病率较高,预后较差的一种类型,五年总体生存率仅25-40%。染色体易位产生的融合蛋白在白血病发病过程中发挥着关键作用。靶向降解融合蛋白已被证明是战胜白血病的有效策略。最典型的例子是三氧化二砷通过诱导融合蛋白PML-RARα降解,在治疗急性早幼粒细胞白血病(约占AML的10-15%)方面取得显著疗效。尽管如此,除急性早幼粒细胞白血病以外,其它AML类型仍然缺乏有效的治疗药物。其中, t(8;21) AML是最常见的伴有染色体易位的AML类型,约占AML的12-20%。t(8;21) AML经化疗后,超过40%的患者复发且产生耐药,预后不佳,迫切需要探索新的治疗策略。
三氧化二砷的成功表明无机药物在靶向降解白血病融合蛋白方面具有潜在作用。受其启发,阎锡蕴院士团队对无机纳米硒在白血病细胞治疗中的效果进行了研究。同时,由于无机药物潜在的毒副作用,其临床应用一直受到限制。为了进一步克服这些限制,研究人员将纳米硒封装在经生物工程改造的铁蛋白纳米笼中。他们发现,相对于实体瘤细胞,载硒铁蛋白表现出对白血病细胞更好的治疗效果。载硒铁蛋白通过抑制组蛋白去乙酰化酶活性,诱导融合蛋白AML1-ETO降解,并调节其靶基因表达,从而显著促使t(8;21)白血病细胞分化(图1)。这一研究为治疗急性髓系白血病开辟了新策略。相关研究成果在线发表于《Advanced Science》杂志。
在本研究中,研究人员将纳米硒封装在经生物工程改造的铁蛋白纳米笼中。这种铁蛋白纳米笼具有均匀的大小,能够选择性地与t(8;21)白血病细胞上高表达标志物TfR1和VLA-4结合。与其它纳米硒相比,这种理性设计的铁蛋白封装的纳米硒能够更有效地识别和进入t(8;21)白血病细胞,并表现出更显著的抗白血病效果。研究发现,纳米硒经铁蛋白递送进入白血病细胞后被代谢成硒代半胱氨酸,通过抑制组蛋白去乙酰化酶活性,诱导融合蛋白AML1-ETO的降解,引起t(8;21)白血病细胞发生分化。以往的研究表明,依赖于Caspase-3途径降解融合蛋白AML1-ETO,主要诱导t(8;21)白血病细胞发生凋亡。然而,与以往研究不同的是,本研究发现载硒铁蛋白通过蛋白酶体途径降解融合蛋白AML1-ETO,主要诱导t(8;21)白血病细胞发生分化。
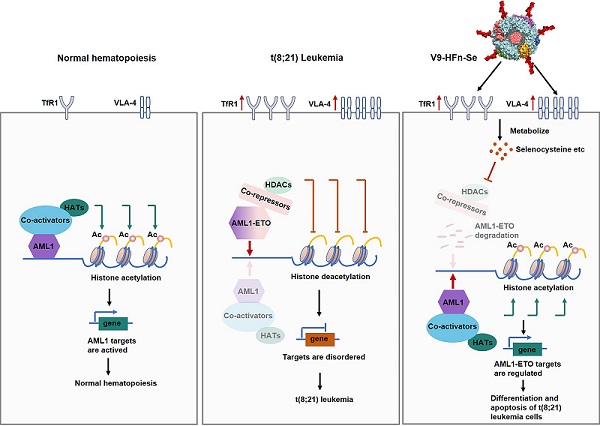
图1:载硒铁蛋白靶向诱导t(8;21)白血病细胞分化示意图
中国科学院生物物理研究所阎锡蕴院士和范克龙研究员为论文通讯作者,中国科学院大学博士研究生方龙、中国科学院生物物理研究所博士后张若飞、北京大学国际医院主治医师史琳为本文共同第一作者。国际遗传工程和生物技术中心-中国区域研究中心杨义力教授为该研究给予了重要指导和帮助;浙江省人民医院临床医学研究所牟晓洲教授和杭州市第一人民医院童向民教授为该研究相关的白血病临床样本实验提供了指导和帮助;暨南大学陈填烽教授为硒纳米颗粒的制备提供了指导和帮助。该研究得到国家重点研发计划、国家自然科学基金、中国科学院青年创新促进会等项目的资助。
文章链接:https://doi.org/10.1002/advs.202300698
(供稿:范克龙研究组)
 附件下载:
附件下载: